 El ojo es un órgano de fácil acceso, que está
altamente compartimentado, lo que permite la administración localizada de
vectores virales a los tejidos oculares específicos, la disminución de las
dosis necesarias para los efectos terapéuticos buscados, y se minimizan los
riesgos sistémicos adversos. Es por esto por lo que el ojo como órgano, ofrece
ventajas únicas como objetivo para la terapia génica.
El ojo es un órgano de fácil acceso, que está
altamente compartimentado, lo que permite la administración localizada de
vectores virales a los tejidos oculares específicos, la disminución de las
dosis necesarias para los efectos terapéuticos buscados, y se minimizan los
riesgos sistémicos adversos. Es por esto por lo que el ojo como órgano, ofrece
ventajas únicas como objetivo para la terapia génica.
Gracias a la comprensión de los mecanismos
genéticos en enfermedades oculares, se han hecho avances significativos, siendo
potencialmente eficaces los tratamientos con sustitución de genes. Las recientes
mejoras en métodos de transferencia de genes oculares a través de vectores, han
aumentado la seguridad y especificidad. Las perspectivas en terapia génica han
avanzado para una variedad de trastornos de la retina, incluyendo la RP.
La sustitución génica y el silenciamiento
genético, han sido utilizados como terapias potencialmente eficaces. Hay
disponibles modelos animales bien caracterizados, usando las funciones del ojo
contralateral como control experimental eficaz, y métodos no invasivos para obtener
imágenes del ojo y poder medir los cambios en la función ocular.
Métodos
de transferencia genética ocular
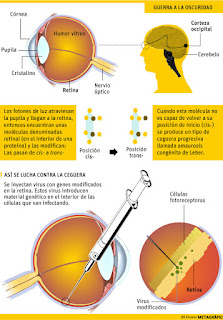
Actualmente el uso de virus adenoasociados (AAV)
se encuentra entre los sistemas de vectores más usados comúnmente para la
terapia génica ocular. Estos tipos de vectores no se integran en el genoma
humano, lo que disminuye significativamente el riesgo de producir tumor por
inserción.
Por lo general, provocan un mínimo de respuestas
inmunes y permiten la expresión estable a largo plazo en el transgen de una
variedad de células de la retina, incluyendo fotorreceptores, células de
Müller, células del EPR y células ganglionares.
Estas características hacen que los vectores de
AAV sean particularmente adecuados para aplicaciones en una amplia variedad de
enfermedades oculares crónicas.
Terapia
génica en retina
Para poder llevar a cabo terapia génica existen
dos requisitos: conocer el gen mutado en cada persona (mediante análisis
genético) con el objetivo de realizar una terapia diseñada adecuadamente para
cada caso. Por otra parte que las células sobre las que se vaya a realizar la
terapia génica no hayan sufrido ya degeneración.
No obstante, en los casos en los que no se
conozca el gen mutado, podría realizarse terapia génica suministrándoles a las
células de la retina el gen de un factor neurotrófico (que se explicará más
adelante), cuya función es la de proteger las neuronas frente a su degeneración
progresiva y/o muerte celular.
A medida que se van conociendo nuevos genes y
mutaciones que causan ceguera, se van aumentando el potencial de llevar a cabo
terapia génica. Aun así, supone un gran reto el introducir genes en los
fotorreceptores tanto de animales de laboratorio como de humanos. Esto se debe
a problemas como, por ejemplo, evitar su degradación una vez inyectados en el
ojo, conseguir dirigirlos a los fotorreceptores, y que además funcionen durante
un largo tiempo
Fuentes:








0 comentarios:
Publicar un comentario